肠道微生物和癌症发展的关系
肠道微生物对肿瘤的影响重点摘选:
1)胃:诱导慢性炎症状态;对胃粘膜有直接的致癌作用。
2)肠:由毒素诱导的慢性炎症状态或信号传导通路的改变;通过标准粘膜屏障的破坏来增强炎症;产生直接致癌的毒素;增加活性氧物质的局部产量;潜在的通过β-连环蛋白-Wnt信号传导通路诱导致癌转录活性;抗肿瘤免疫功能受损。
3)肝/胆道:通过门静脉系统接触细菌和/或其代谢物;继发性胆汁酸的产生可能会改变免疫功能(影响防止原发性和转移性肿瘤生长的NK T细胞浓度;二级胆汁酸和其他机制引起的DNA损伤和肝毒性;诱导非酒精性脂肪性肝炎和其他可能导致肝硬化并可能引发癌症形成的疾病。
4)乳房:影响循环雌激素的水平;改变能量代谢的平衡。
越来越多的证据表明我们肠道内的微生物群落(包括细菌、古细菌、病毒、真菌、原生动物和其他微生物)会对整体健康和疾病反应产生深远的影响。这一复杂的生态系统也受到许多因素的影响,包括地理、饮食和药物。肠道生态失调的典型特征是微生物多样性减少和/或常驻物种质的改变。有证据表明,肠道微生物菌群的生态失调会增加感染的易感性,并削弱疫苗反应,肠道微生物菌群的生理障碍也涉及许多自身免疫和炎症状况,包括IBD(炎症性肠病)、多发性硬化症(MS)、I型糖尿病和类风湿性关节炎(RA)。对于癌症也是如此,其中某些细菌和病毒与细胞发育不良和致癌作用有关(图1)。已知的致癌肠道细菌包括在胃癌中的伤寒沙门氏菌(Salmonella typhi)和螺杆菌属(Helicobacter spp)、胆道癌中的幽门螺杆菌(Helicobacter pylori)等。在大多数这些病例中,致癌作用被认为是局部产生慢性炎症状态的继发后果;然而,一些细菌,包括幽门螺杆菌(H. pylori),具有直接的致癌作用,可以改变调节粘膜细胞生长和增殖的关键细胞内信号通路。幽门螺旋杆菌与胃腺癌和粘膜相关淋巴组织(MALT淋巴瘤)相关,并被世界卫生组织(WHO)鉴定为I类致癌物。肠道微生物菌群可能有具有致癌作用。在多项大型病例对照研究中已经证实抗生素治疗与各种胃肠道(GI)-肿瘤和非胃肠道肿瘤的发展之间的联系。研究者也提出肠道微生物生态失调影响的癌症类型和肿瘤发生和/或肿瘤生长的机制是多样的(图1)。但目前仍缺乏对该机制的全面见解。
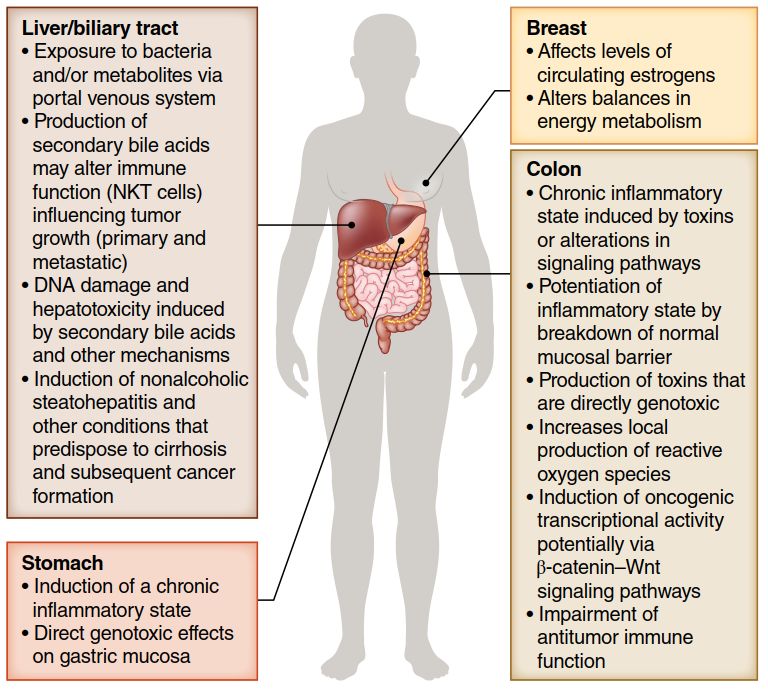
▲图1 肠道微生物对肿瘤发展的影响
肠道微生物和癌症治疗之间相互影响
1)肠道微生物对癌症治疗方式的影响
除了在致癌中的作用外,肠道微生物群现已被证明在癌症治疗的反应中起关键作用。已发表的研究表明肠道微生物群通过各种机制影响肿瘤治疗的反应和毒性。


▲图2 肠道微生物对不同癌症治疗方式的影响

▲图3 现有研究发现的在癌症发展和治疗反应中具有作用的肠道微生物(蓝色条带代表在有益治疗反应下富集的微生物类群;红色条带代表在治疗无反应下富集的微生物类群)
2)癌症治疗对肠道微生物群的影响
癌症治疗可能反过来影响微生物群。化疗可导致严重的生态失调并影响多种代谢通路。化疗过程中经常存在的抗生素使用也影响微生物菌群。目前在一些研究中同时进行抗生素治疗会对癌症免疫治疗的效果产生负面影响。在手术的情况下,可以通过施用药理学(抗生素)和/或渗透性肠道制剂来破坏肠道微生物群。放射治疗还可能通过破坏肠道和/或结肠粘膜来影响肠道微生物菌群,从而改变胆汁盐的吸收和大便次数。
3)肠道微生物菌群与治疗毒性
除了介导治疗反应之外,肠道微生物菌群还调节癌症治疗的毒性。几种肠道细菌类群可能对癌症免疫疗法的毒性具有保护作用,包括Bacteroidetes(拟杆菌)和Bifidobacterium(双歧杆菌)。而一些细菌类群也可能与有利的反应和毒性相关,如Firmicutes(厚壁菌门)。临床前模型显示肠道微生物群通过增加背根神经节中的活性氧和促炎细胞因子,促进肿瘤细胞毒性和机械痛觉过敏,因此在奥沙利铂治疗的反应中起双重作用。放射治疗也被证明可以改变临床前模型中肠道微生物群的组成,减少Firmicutes的数量,增加Proteobacteria(变形菌门)的数量,从而提高对放射性结肠炎的易感性。
肿瘤内微生物的作用
在肿瘤本身内检测到细菌的存在,这些瘤种包括肺癌、乳腺癌、结肠癌、胃癌、胰腺癌、胆管癌、卵巢癌和前列腺癌。虽然肠道、呼吸系统或生殖系统的肿瘤通常暴露于微生物环境中,但是更难以解释其他器官的肿瘤中细菌的生长。
虽然与肠道微生物群相比,瘤内细菌可以影响患者结果的直接证据较少,但它们可能对癌症治疗的反应也有一定影响。这些肿瘤内细菌具有代谢活性,通常在肿瘤中发现的细菌可以改变常见化疗药物的化学结构,通过增加或减少其含量来改变化疗药物的活性,从而改变它们的有效局部浓度。某些细菌类群,包括Gammaproteobacteria(变形菌),其表达可以灭活吉西他滨(常用于治疗胃肠道恶性肿瘤的强效化疗药物)的胞苷脱氨酶异构体,从而降低该药物的局部浓度并赋予对这种药物的抗性。肿瘤内微生物菌群对癌症治疗反应的影响不限于酶活性。例如,Fusobacterium(梭杆菌)可以通过激活癌细胞上的TLRs(Toll样受体)以及随后肿瘤内某些miRNAs的丢失和自噬来赋予CRC对化疗的耐药性。
肿瘤环境中细菌的存在本身可以是一种免疫调节。一些研究结果支持细菌在肿瘤环境中的免疫刺激作用,而一些研究也表明肿瘤内细菌产生主要的免疫抑制微环境。在临床前模型中,通过瘤内先天免疫细胞识别细菌可以激活促炎细胞因子的产生,驱动各种免疫细胞的进一步浸润并改善抗原呈递,从而增强抗肿瘤的免疫功能。瘤内细菌还可以改变免疫免疫和癌细胞上的配体和受体的表达,而这些细胞是目前免疫治疗的靶标之一。肿瘤内微生物也被证明具有免疫抑制作用,其可以富集骨髓来源的抑制性细胞(MDSCs),并增加免疫抑制细胞因子的产生,或激活替代性免疫检查点,从而产生非细胞溶解反应。降低胰腺癌瘤内细菌负荷的抗生素治疗已被证明可减少抑制细胞的富集、增加先天效应细胞的富集、增加细胞溶解性T细胞的活性。
靶向微生物组的癌症治疗策略
目前研究者们正在努力通过调节肠道微生物群来增强治疗反应和/或消除与治疗相关的毒性。可以通过施用FMT、益生菌或特定细菌,改变饮食或生活方式、使用定制的抗生素疗法或噬菌体的靶向调节修饰来进行靶向微生物组的癌症治疗(图4)。

▲图4 靶向微生物组的癌症治疗策略
现在的证据表明,人体微生物可能通过局部存在于肿瘤微环境中的直接作用或通过远处微生物群(例如肠和皮肤)的系统性影响而赋予对某些癌症的易感性。相关研究也表明,抗肿瘤治疗会影响人体肠道微生物群落的分布、数量及种类,进而刺激宿主产生免疫应答,导致并发症发生,最终影响疗效及预后。现有研究资料及证据提示,肠道微生物稳态可能是抗肿瘤治疗成功的一个重要条件。目前关于肠道微生物群落对抗肿瘤治疗结局的具体影响尚未明确,我们目前对人类微生物菌群影响的认识还远不足够。在微生物与肿瘤领域,从基础研究和转化研究到临床研究和流行病学分析,各个层面的研究都有着巨大的机会,这些研究可推进我们对这一复杂生态系统的理解。尽管目前的癌症治疗取得相当大的进展,但从预后和治疗角度考虑所有的因素也很重要,因此需要设计多方面的策略来监测和调节这些因素,只有这样,我们才能充分发挥精准医学的潜力。
肠道微生物对肿瘤的影响重点摘选:
1)胃:诱导慢性炎症状态;对胃粘膜有直接的致癌作用。
2)肠:由毒素诱导的慢性炎症状态或信号传导通路的改变;通过标准粘膜屏障的破坏来增强炎症;产生直接致癌的毒素;增加活性氧物质的局部产量;潜在的通过β-连环蛋白-Wnt信号传导通路诱导致癌转录活性;抗肿瘤免疫功能受损。
3)肝/胆道:通过门静脉系统接触细菌和/或其代谢物;继发性胆汁酸的产生可能会改变免疫功能(影响防止原发性和转移性肿瘤生长的NK T细胞浓度;二级胆汁酸和其他机制引起的DNA损伤和肝毒性;诱导非酒精性脂肪性肝炎和其他可能导致肝硬化并可能引发癌症形成的疾病。
4)乳房:影响循环雌激素的水平;改变能量代谢的平衡。
越来越多的证据表明我们肠道内的微生物群落(包括细菌、古细菌、病毒、真菌、原生动物和其他微生物)会对整体健康和疾病反应产生深远的影响。这一复杂的生态系统也受到许多因素的影响,包括地理、饮食和药物。肠道生态失调的典型特征是微生物多样性减少和/或常驻物种质的改变。有证据表明,肠道微生物菌群的生态失调会增加感染的易感性,并削弱疫苗反应,肠道微生物菌群的生理障碍也涉及许多自身免疫和炎症状况,包括IBD(炎症性肠病)、多发性硬化症(MS)、I型糖尿病和类风湿性关节炎(RA)。对于癌症也是如此,其中某些细菌和病毒与细胞发育不良和致癌作用有关(图1)。已知的致癌肠道细菌包括在胃癌中的伤寒沙门氏菌(Salmonella typhi)和螺杆菌属(Helicobacter spp)、胆道癌中的幽门螺杆菌(Helicobacter pylori)等。在大多数这些病例中,致癌作用被认为是局部产生慢性炎症状态的继发后果;然而,一些细菌,包括幽门螺杆菌(H. pylori),具有直接的致癌作用,可以改变调节粘膜细胞生长和增殖的关键细胞内信号通路。幽门螺旋杆菌与胃腺癌和粘膜相关淋巴组织(MALT淋巴瘤)相关,并被世界卫生组织(WHO)鉴定为I类致癌物。肠道微生物菌群可能有具有致癌作用。在多项大型病例对照研究中已经证实抗生素治疗与各种胃肠道(GI)-肿瘤和非胃肠道肿瘤的发展之间的联系。研究者也提出肠道微生物生态失调影响的癌症类型和肿瘤发生和/或肿瘤生长的机制是多样的(图1)。但目前仍缺乏对该机制的全面见解。

▲图1 肠道微生物对肿瘤发展的影响
肠道微生物和癌症治疗之间相互影响
1)肠道微生物对癌症治疗方式的影响
除了在致癌中的作用外,肠道微生物群现已被证明在癌症治疗的反应中起关键作用。已发表的研究表明肠道微生物群通过各种机制影响肿瘤治疗的反应和毒性。


▲图2 肠道微生物对不同癌症治疗方式的影响

▲图3 现有研究发现的在癌症发展和治疗反应中具有作用的肠道微生物(蓝色条带代表在有益治疗反应下富集的微生物类群;红色条带代表在治疗无反应下富集的微生物类群)
2)癌症治疗对肠道微生物群的影响
癌症治疗可能反过来影响微生物群。化疗可导致严重的生态失调并影响多种代谢通路。化疗过程中经常存在的抗生素使用也影响微生物菌群。目前在一些研究中同时进行抗生素治疗会对癌症免疫治疗的效果产生负面影响。在手术的情况下,可以通过施用药理学(抗生素)和/或渗透性肠道制剂来破坏肠道微生物群。放射治疗还可能通过破坏肠道和/或结肠粘膜来影响肠道微生物菌群,从而改变胆汁盐的吸收和大便次数。
3)肠道微生物菌群与治疗毒性
除了介导治疗反应之外,肠道微生物菌群还调节癌症治疗的毒性。几种肠道细菌类群可能对癌症免疫疗法的毒性具有保护作用,包括Bacteroidetes(拟杆菌)和Bifidobacterium(双歧杆菌)。而一些细菌类群也可能与有利的反应和毒性相关,如Firmicutes(厚壁菌门)。临床前模型显示肠道微生物群通过增加背根神经节中的活性氧和促炎细胞因子,促进肿瘤细胞毒性和机械痛觉过敏,因此在奥沙利铂治疗的反应中起双重作用。放射治疗也被证明可以改变临床前模型中肠道微生物群的组成,减少Firmicutes的数量,增加Proteobacteria(变形菌门)的数量,从而提高对放射性结肠炎的易感性。
肿瘤内微生物的作用
在肿瘤本身内检测到细菌的存在,这些瘤种包括肺癌、乳腺癌、结肠癌、胃癌、胰腺癌、胆管癌、卵巢癌和前列腺癌。虽然肠道、呼吸系统或生殖系统的肿瘤通常暴露于微生物环境中,但是更难以解释其他器官的肿瘤中细菌的生长。
虽然与肠道微生物群相比,瘤内细菌可以影响患者结果的直接证据较少,但它们可能对癌症治疗的反应也有一定影响。这些肿瘤内细菌具有代谢活性,通常在肿瘤中发现的细菌可以改变常见化疗药物的化学结构,通过增加或减少其含量来改变化疗药物的活性,从而改变它们的有效局部浓度。某些细菌类群,包括Gammaproteobacteria(变形菌),其表达可以灭活吉西他滨(常用于治疗胃肠道恶性肿瘤的强效化疗药物)的胞苷脱氨酶异构体,从而降低该药物的局部浓度并赋予对这种药物的抗性。肿瘤内微生物菌群对癌症治疗反应的影响不限于酶活性。例如,Fusobacterium(梭杆菌)可以通过激活癌细胞上的TLRs(Toll样受体)以及随后肿瘤内某些miRNAs的丢失和自噬来赋予CRC对化疗的耐药性。
肿瘤环境中细菌的存在本身可以是一种免疫调节。一些研究结果支持细菌在肿瘤环境中的免疫刺激作用,而一些研究也表明肿瘤内细菌产生主要的免疫抑制微环境。在临床前模型中,通过瘤内先天免疫细胞识别细菌可以激活促炎细胞因子的产生,驱动各种免疫细胞的进一步浸润并改善抗原呈递,从而增强抗肿瘤的免疫功能。瘤内细菌还可以改变免疫免疫和癌细胞上的配体和受体的表达,而这些细胞是目前免疫治疗的靶标之一。肿瘤内微生物也被证明具有免疫抑制作用,其可以富集骨髓来源的抑制性细胞(MDSCs),并增加免疫抑制细胞因子的产生,或激活替代性免疫检查点,从而产生非细胞溶解反应。降低胰腺癌瘤内细菌负荷的抗生素治疗已被证明可减少抑制细胞的富集、增加先天效应细胞的富集、增加细胞溶解性T细胞的活性。
靶向微生物组的癌症治疗策略
目前研究者们正在努力通过调节肠道微生物群来增强治疗反应和/或消除与治疗相关的毒性。可以通过施用FMT、益生菌或特定细菌,改变饮食或生活方式、使用定制的抗生素疗法或噬菌体的靶向调节修饰来进行靶向微生物组的癌症治疗(图4)。

▲图4 靶向微生物组的癌症治疗策略
现在的证据表明,人体微生物可能通过局部存在于肿瘤微环境中的直接作用或通过远处微生物群(例如肠和皮肤)的系统性影响而赋予对某些癌症的易感性。相关研究也表明,抗肿瘤治疗会影响人体肠道微生物群落的分布、数量及种类,进而刺激宿主产生免疫应答,导致并发症发生,最终影响疗效及预后。现有研究资料及证据提示,肠道微生物稳态可能是抗肿瘤治疗成功的一个重要条件。目前关于肠道微生物群落对抗肿瘤治疗结局的具体影响尚未明确,我们目前对人类微生物菌群影响的认识还远不足够。在微生物与肿瘤领域,从基础研究和转化研究到临床研究和流行病学分析,各个层面的研究都有着巨大的机会,这些研究可推进我们对这一复杂生态系统的理解。尽管目前的癌症治疗取得相当大的进展,但从预后和治疗角度考虑所有的因素也很重要,因此需要设计多方面的策略来监测和调节这些因素,只有这样,我们才能充分发挥精准医学的潜力。
